I ricercatori dell’Università di Glasgow stanno ampliando le loro ricerche sulla bioprinting, con le loro scoperte delineate nei micropeli Bacteria laden recentemente pubblicati come ambienti 3D autonomi per l’ingegneria delle cellule staminali . Il team ha sviluppato un sistema microfluidico costituito da un unico passaggio, che consente di contenere sia cellule staminali sia batteri non patogeni geneticamente modificati in un microgel di alginato.
Mentre la maggior parte delle tecniche si basa sull’estrusione di gocce, qui i ricercatori stanno creando un sistema più efficiente tramite un metodo microfluidico a goccia singola. La fabbricazione dei microgel di pizzo perlato avviene a pH fisiologico senza alcun materiale di rivestimento, con dimensioni del canale e design complessivo per evitare stress di taglio sulle celle e incoraggiare la vitalità.
“Il fabbricato in gel fabbricato è unico nel suo modo di avere sia unità compartimentate come in microcapsule individuali, sia la connettività presente nei costrutti fibrosi”, affermano i ricercatori. “Si è anche notato che le microunità compartimentate e il collegamento che le collega sono altamente sintonizzabili risultando in strutture di interconnessione di perle perlati altamente mono-disperse”.
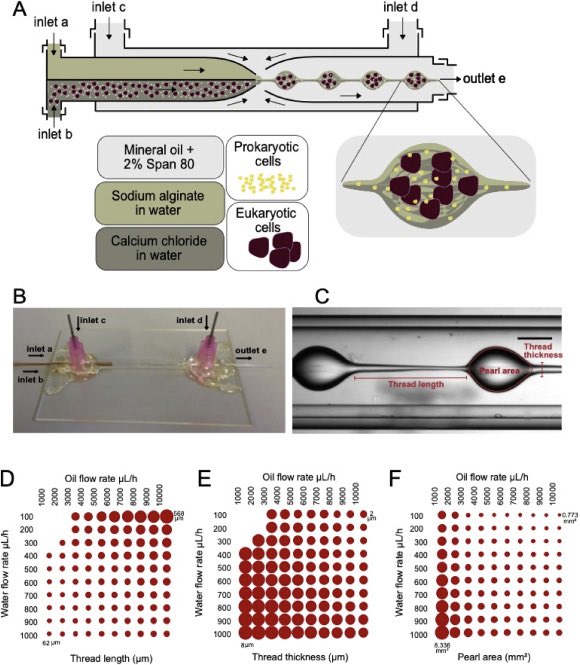
Configurazione microfluidica basata su goccioline. (A) Rappresentazione schematica del dispositivo microfluidico e incapsulamento di cellule procariotiche ed eucariotiche. (B) Immagine del dispositivo microfluidico a base di capillari. (C) Un’istantanea di formazione di perle in dispositivo microfluidico con indicazione dei parametri utilizzati per quantificare le perle assemblate. (D) Grafico dello spessore del filo con le portate corrispondenti (asse Y: flusso d’acqua, asse X: flusso dell’olio). (E) Grafico dello spessore del filo. (F) Grafico area perlata.
Per questo progetto, i ricercatori hanno creato un modello 3D in vitro per indagare la simbiosi del commensalismo tra cellule staminali mesenchimali eucariotiche (hBM-MSC) e cellule procariotiche (batteri ingegnerizzati non patogeni Lactococcus lactis , L. lactis ).
Mentre i batteri sono comunemente usati come un “organismo di produzione” a prezzi accessibili per le proteine nella bioprinting, possono anche fungere da meccanismo per dirigere la crescita e la differenziazione delle cellule. I ricercatori hanno anche usato un antibiotico batteriostatico, sulfametossazolo, per prevenire la crescita di batteri nocivi.
Sono state fabbricate quattro forme stampate in 3D, tra cui una linea, un triangolo, un quadrato e un cerchio, e una disposizione come segue:
Linea – due dischi circolari (angolo di 180 gradi)
Tre per triangolo (angolo interno di 60 gradi)
Quattro per quadrato (angolo interno di 90 gradi)
Otto per una forma a forma di cerchio (angolo interno di 135 gradi, ottagono)
I sistemi microfluidici hanno permesso ai ricercatori di creare costrutti “mono-dispersi” che sono adatti per applicazioni come screening farmacologici, studi biologici e medicina personalizzata.
Immagini SEM di costrutti di alginato carichi di cellule. Immagini a contrasto di fase di microgel di alginato con MSC in mezzi basali (A); microgel di alginato con MSC in mezzi osteogenici (B); microgel di alginato con MSC contenente due colonie di L. lactis (C) che esprimono FNIII 7-10 o BMP-2 in modo costitutivo. I campioni sono stati fissati dopo due settimane di coltura. Scala: 100 μm. Immagini SEM del costrutto di alginato con MSC in mezzi basali, le immagini mostrano il segno impresso dalla cella sulla sezione trasversale di un costrutto di alginato (D); microgel di alginato con MSC e due colonie di L. lactis che sovrappongono lo spazio (E); microgel di alginato con MSC in mezzi osteogenici, entità rotonde che coprono le cellule, cavità e finissimi costrutti simili a membrane (F). Gli idrogel erano leggermente disidratati / rimpiccioliti rispetto al loro stato nei mezzi acquosi

“La connettività degli idrogel di pizzo perlato può fornire una via per studi di gradiente in cui la popolazione di ciascun tipo di cellula e quindi la sua densità relativa possono essere controllati. Può anche essere utilizzato per gli studi di indicizzazione delle serie temporali e fornire un mezzo per realizzare prototipi di bio-stampa 3D a basso costo e facili da fabbricare, come dimostrato in questo studio “, hanno concluso i ricercatori.
“Microgel in questo studio è stato utilizzato come prova di concetto per la modellazione di una piattaforma sintonizzabile in cui sia l’idrogel che agisce come ECM che la produzione e il rilascio del fattore di crescita possono essere progettati sia a basso costo con controllo spazio-temporale di alta precisione . È stato un tentativo di ingegnerizzare ulteriormente più aspetti di un sistema in vitro, aprendo la strada per lo studio delle cellule e la loro interazione con l’ambiente dinamico regolabile di tipo ECM con un maggiore controllo. “
Mentre i progressi della bioprinting continuano a prendere piede nella ricerca globale, gli scienziati creano nuovi inchiostri per bioprinting , microsuperfici stampati in 3D , tecniche progressive microfluidiche e altro ancora. Cosa ne pensi di questa notizia? Fateci sapere i vostri pensieri! Partecipa alla discussione di questo e altri argomenti di stampa 3D su 3DPrintBoard.com .
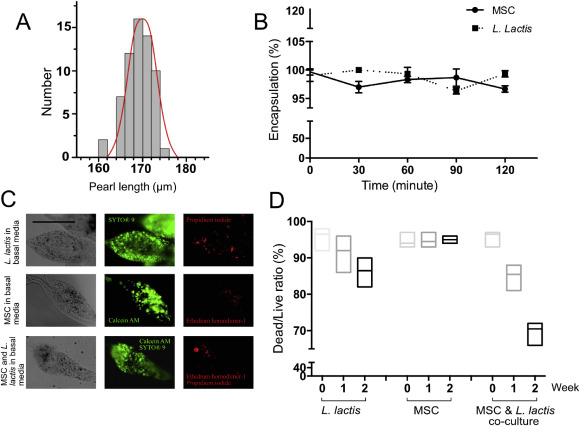
Mono-dispersività, incapsulamento e vitalità di microsfere. (A) Distribuzione delle dimensioni della perla (asse lungo) dell’idrogel prodotto di due flussi di fluido miscibile in condizioni di flusso laminare utilizzando portate di 500 μl h-1 per le due fasi interne e 5000 μl di h-1 per la fase esterna. N ≥ 5 – 10 microgel sono stati analizzati per ciascuna condizione. La lunghezza media della perla formata era di 167 μm con una RSD del 3,2%. Scala: 100 μm. (B) Efficienza di incapsulamento cellulare (MSC e L. lactis) dall’idrogel formato. I conteggi delle cellule in ciascun punto temporale sono il risultato di 8 misurazioni acquisite sequenzialmente a intervalli di 30 minuti a temperatura ambiente per 2 ore. (C) Immagini fluorescenti di idrocel di alginato di due settimane con L. lactis e MSC. L’idrogel è stato colorato con il kit di vitalità batterica BacLight per L. lactis e Kit di vitalità / citotossicità, per MSC. Entrambi i kit colorano le cellule vitali in verde (SYTO® 9 e Calcein AM) e le cellule non vitali in rosso (Propidio ioduro e Ethidium omodimero-1), una miscela 50:50 dei kit è stata utilizzata per la co-coltura. Scala: 100 μm. (D) Il grafico di vitalità di L. lactis, MSC e co-coltura.